Hydrure de titane(IV)
| Tétrahydrure de titane | |
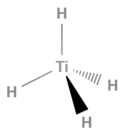
| |
| Structure du tétrahydrure de titane | |
| Identification | |
|---|---|
| Nom systématique | hydrure de titane(IV) |
| Synonymes |
tétrahydrure de titane |
| No CAS | |
| No ECHA | 100.035.414 |
| No CE | 238-972-5 |
| PubChem | 187779 |
| Propriétés chimiques | |
| Formule | H4Ti |
| Masse molaire[1] | 51,899 ± 0,001 g/mol H 7,77 %, Ti 92,23 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le tétrahydrure de titane, ou hydrure de titane(IV), est un composé chimique de formule TiH4. Extrêmement instable, il n'a jamais été isolé en quantité macroscopique à l'état pur et est étudié dans des matrices gazeuses cryogéniques. Ses propriétés macroscopiques ne sont pas bien caractérisées mais il a été modélisé par chimie numérique. Sa forme moléculaire serait ainsi un gaz incolore thermiquement très instable.
Synthèse
[modifier | modifier le code]Le tétrahydrure de titane a été produit pour la première fois en 1963 par photodissociation de mélanges de tétrachlorure de titane TiCl4 et d'hydrogène H2 immédiatement suivie d'une spectrométrie de masse[2]. Il fallait réaliser l'analyse rapidement en raison de la grande instabilité de la molécule TiH4. L'analyse numérique a donné une énergie théorique de dissociation des liaisons Ti−H de 132 kcal/mol par rapport à M + 4 H[3]. TiH4 se dissocie en titane métallique et hydrogène :
Outre TiH4, les espèces TiH, TiH2, TiH3 et polymères ont été isolées à basse température après ablation laser de titane en présence d'hydrogène[4].
Structure
[modifier | modifier le code]On pense que le tétrahydrure de titane solide forme des polymères dans lesquels les molécules TiH4 sont liées par des liaisons covalentes[5]. Les modélisations numériques suggèrent que TiH4 tende à dimériser[4]. Ceci serait dû au déficit du monomère en électrons ainsi qu'à la petite taille des ligands hydrure, qui faciliterait la dimérisation en limitant la répulsion inter-ligands et donc l'énergie d'activation.
Les calculs indiquent que le dimère est une molécule fluxionnelle (en) qui s'interconvertit rapidement entre un certain nombre de formes présentant toutes des hydrogènes pontants dans le cadre de liaisons à trois centres et deux électrons.
Le monomère TiH4 est la molécule de métal de transition la plus simple présentant une hybridation sd3[6].
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Peter Breisacher et Bernard Siegel, « Formation of Gaseous Titanium(IV) Hydride and Chlorohydrides of Titanium », Journal of the American Chemical Society, vol. 85, no 11, , p. 1705-1706 (DOI 10.1021/ja00894a049, lire en ligne).
- (en) Diane M. Hood, Russell M. Pitzer et Henry F. Schaefer III, « Electronic structure of homoleptic transition metal hydrides: TiH4, VH4, CrH4, MnH4, FeH4, CoH4, and NiH4 », The Journal of Chemical Physics, vol. 71, no 2, , p. 705-712 (DOI 10.1063/1.438357, Bibcode 1979JChPh..71..705H, lire en ligne).
- (en) George V. Chertihin et Lester Andrews, « Reactions of Laser Ablated Ti Atoms with Hydrogen during Condensation in Excess Argon. Infrared Spectra of the TiH, TiH2, TiH3, and TiH4 Molecules », Journal of the American Chemical Society, vol. 116, no 18, , p. 8322-8327 (DOI 10.1021/ja00097a045, lire en ligne).
- (en) Simon P. Webb et Mark S. Gordon, « The Dimerization of TiH4 », Journal of the American Chemical Society, vol. 117, no 25, , p. 7195-7201 (DOI 10.1021/ja00132a020, lire en ligne).
- (en) V. Jonas, C. Boehme et G. Frenking, « Bent's Rule and the Structure of Transition Metal Compounds », Inorganic Chemistry, vol. 35, no 7, , p. 2097-2099 (DOI 10.1021/ic951397o, lire en ligne).
